Desempeños a fortalecer:
· Identifica como se encuentra n organizados los elementos químicos en la tabla periódica.
ACTIVIDADES PROPUESTAS
INSTRUCCIÓN: Lee
atentamente y responde las preguntas en hojas de block con letra
legible.
1. ¿Qué es la tabla periódica?
2. ¿Cómo se encuentran organizados los elementos
químicos en la tabla periódica?
3. ¿Para qué se usa la información que se encuentra en
la tabla periódica?
4. Completa el siguiente texto utilizando las palabras claves : temperatura, fusión,
constante, ebullición.
Al calentar un sólido se transforma en líquido; este cambio de estado se denomina________ . El punto de fusión es la ________________ a la que ocurre dicho proceso. Al subir la temperatura de un líquido se alcanza un punto en el que se forman burbujas de vapor en su interior, es el punto de ________________; en ese punto la temperatura del líquido permanece _____________________.
5. Explica por qué es importante las propiedades
periódicas.
6. Realizar las propiedades periódicas para los
elementos oxígeno e hidrógeno.
7. Determine el elemento químico que conforma cada uno
de los materiales que se relacionan en la Tabla (o el más abundante). Con base
en esta información, consulte la Tabla periódica para completarla.
8. ¿Cuáles son los cambios de estado de la materia?
9. ¿Cuáles son los estados de la materia? y hacer los
dibujos
10. ¿Cuáles son las propiedades fundamentales de la
materia?
11. Realiza la valencia para los siguientes compuestos.
12. Realiza la valencia para las siguientes preguntas
a. Los metales alcalinos están en la misma familia de la tabla periódica. ¿Cuál es su número de grupo y cuántos electrones de valencia tiene cada uno?
b. Los halógenos están en la misma familia de la tabla
periódica. ¿Cuál es su número de grupo y cuántos electrones de valencia tiene
cada uno?
13. Escribe la configuración electrónica para el elemento que se localiza en:
a. Grupo III A y
periodo 4
b. Grupo VII A y
periodo 3
SEMANA NUMERO 26
FECHA: 12 de Agosto al
16 de Agosto
TEMA: Taller preliminar sobre el medio ambiente
OBJETIVO: Presentación del docente y conocer dar a conocer la temática que se va a desarrollar durante el periodo.
LECTURA SOBRE EL MEDIO AMBIENTE
Se entiende por ambiente todo lo que afecta a un ser vivo y condiciona especialmente las circunstancias de vida de las personas o la sociedad en su vida. Comprende el conjunto de valores naturales, sociales y culturales existentes en un lugar y un momento determinado, que influyen en la vida del ser humano y en las generaciones venideras. Es decir, no se trata sólo del espacio en el que se desarrolla la vida sino que también abarca seres vivos, objetos, agua, suelo, aire y las relaciones entre ellos, así como elementos tan intangibles como la cultura.
El medio ambiente es muy importante, porque de el obtenemos agua, comida, combustibles y materias primas que sirven para fabricar las cosas que utilizamos diariamente. El es nuestro hogar, de el depende nuestra existencia humana. Al abusar o hacer mal uso de los recursos naturales que se obtienen del medio ambiente, lo ponemos en peligro y lo agotamos. El aire y el agua están contaminándose, los bosques están desapareciendo, debido a los incendios y a la explotación excesiva y los animales se van extinguiendo por el exceso de la caza y de la pesca.
Por lo consiguiente, si el medio
ambiente es nuestra casa, porque lo estamos destruyendo? el nos brinda todos los recursos indispensable
para la continuidad de la vida en el planeta. Es nuestra casa, cuidemos y conservemos
de ella no solo por nosotros, sino por nuestros hijos y nietos
ACTIVIDAD
De acuerdo al texto responde:
1. ¿Qué es el medio ambiente?
2. ¿Qué acciones humanas
destruyen el medio ambiente?
3. ¿Por qué es importante cuidar
el medio ambiente?
4. Escribe cinco acciones sobre ¿cómo podemos evitar
que el medio ambiente sea destruido?
5. Elabora una frase en donde
expreses amor y cuidado por el medio ambiente
6. Elabora un dibujo sobre el
cuidado que debemos tener con el medio ambiente
SEMANA
NUMERO 27
Fecha: 19 de Agosto al 23 de Agosto
TEMA: Estructura del átomo
Objetivo: Explicar la diferencia entre protones, neutrones y electrones.
ESTRUCTURA DEL ATOMO
Un conjunto de átomos del mismo
tipo forman un elemento químico determinado.
Para poder representar y distinguir un elemento químico se utiliza un símbolo químico y dos números, conocidos como: número atómico y número másico.
El número atómico (Z) indica el número de protones que contiene el núcleo atómico. Para un átomo neutro, el número de protones es idéntico al número de electrones.
El número másico (A) indica el número de protones más neutrones que tiene el átomo en su núcleo.
ACTIVIDAD
1. LECTURA COMPRENSIVA
Desde la antigüedad los filósofos se preguntaban de qué estaban formadas las cosas que los rodeaban. Primero pensaron que la materia era continua, es decir, que se podía dividir indefinidamente. Sin embargo, en el siglo V a. C., Leucipo (450-370 a. C.) y su discípulo Demócrito (460-370 a. C.) postularon la idea de que la materia era discontinua, es decir, que se podía dividir solo hasta cierto punto, ya que estaba formada por diminutas partículas a las que llamó átomos (a=sin; tomos=división).
Como la idea de Demócrito solo
fue basada en su intuición (no tenía datos experimentales) no se tomó en cuenta
por mucho tiempo. Solo unos 2.000 años después, John Dalton (1766-1844) retomó
la idea planteada por Demócrito.
Con base al texto responde:
1.- Demócrito postuló que la materia era _______________________, y estaba formada
por una partícula a la
cual llamó átomo que significa __________________.
2.- En un principio se pensaba
que la materia era________________.
3.- Las partículas que encontramos en el núcleo son ______________
que posee
carga___________________ y los _________________ que no poseen carga.
4.- El número másico indica el
número de ____________________ más ___________.
5.- La envoltura nuclear está formada por los ________________ que poseen carga______.
6.- El número atómico A
representa la cantidad de ____________________ que están en el núcleo.
7.- La cantidad de electrones y
protones es ______________________.
Completa la
siguiente información para cada uno de
los siguientes elementos
|
Elemento |
Número atómico |
Número másico |
Número de protones |
Número de electrones |
Número de neutrones |
|
33 As 75
|
|
|
|
|
|
|
24 Cr 52 |
|
|
|
|
|
|
1 H 1 |
|
|
|
|
|
|
15 P 31 |
|
|
|
|
|
|
30 Zn 65 |
|
|
|
|
|
|
82
Pb 207 |
|
|
|
|
|
SEMANA
NUMERO 28
Fecha: 26 de agosto al 30 de agosto
Tema: Configuración electrónica de los átomos
Objetivo: Determinar las propiedades totales de combinación química de los átomos, y por lo tanto suposición en la tabla periódica de los elementos.
CONFIGURACIÓN
ELECTRÓNNICA
Según la teoría atómica actual, los electrones de un átomo se organizan alrededor del núcleo en órbitas o niveles, los cuales corresponden a regiones de espacio en las que existe una alta probabilidad de hallar o encontrar un electrón. Cada nivel se puede subdividir en subniveles.
A la representación de la forma cómo se distribuyen los electrones en los distintos subniveles de energía se llama configuración electrónica de un átomo.
De esta distribución depende gran parte de las propiedades físicas y todas las propiedades químicas del átomo. La distribución de los electrones se fundamenta en los siguientes principios.
Principio de exclusión de Pauli: en un átomo no pueden existir dos electrones cuyos cuatro números cuánticos sean iguales. Esto significa que en un orbital solo puede haber un máximo de dos electrones, cuyos spines respectivos serán: +1/2 y -1/2. Cada electrón con diferente spin se representa con flechas hacia arriba y hacia abajo.
Regla de la máxima multiplicidad
o regla de Hund: cuando hay orbitales de equivalente energía disponible, los
electrones se ubican de uno en uno y no por pares. Esto quiere decir que cada
uno de los orbitales tiene que estar ocupado por un electrón, antes de asignar un
segundo electrón a cualquiera de ellos. Los spines de estos electrones deben
ser iguales.
Principio de Aufbau o de relleno: los electrones van ocupando los subniveles disponibles en el orden en el que aumentan su energía, y la secuencia de ocupación viene determinada por el triángulo de Pauli.
Energías relativas: establecen que los electrones comienzan a ubicarse en orbitales de mayor a menor energía.
Ley del octeto: la mayoría de elementos tienden a alcanzar un grado alto de estabilidad, lo cual, en términos químicos, significa que no reaccionan químicamente. En términos de distribución de electrones, en un átomo no pueden existir más de ocho electrones en el nivel más externo de energía.
El número atómico Z=5; significa que este elemento tiene cinco electrones. Empezamos llenando el orbital de menor energía 1s con dos electrones que tendrán diferente spin (ms) .
Los dos electrones siguientes con spin contrario ocuparán el siguiente subnivel 2s. El electrón restante ocupará el orbital 2p, que es el siguiente con menor energía.
Esta distribución de los electronesen el átomo de boro se representa de la siguiente manera
1s2 2s2 2p1.
ACTIVIDAD
1. Escribe la configuración
electrónica de los siguientes elementos y realiza el diagrama de Bohr:
a. Litio:
b. Oxígeno:
c. Galio:
d. Níquel:
e. Cloro:
f. Estroncio:
2. Identifica a qué elemento
pertenece cada una de las siguientes configuraciones:
a) 1s2 2s2 2p1 =
b) 1s2 2s2 2p4 =
c) 1s2 2s2 2p6 3s2 3p6 =
d) 1s2 2s2 2p6 3s2 3p6 4s2 3d1 =
SEMANA NUMERO 29
FECHA: 2 de Septiembre al 6 de Septiembre
TEMA: Número de oxidación de los elementos químicos
OBJETIVO: Determina los estados de oxidación de los elementos en su estado libre o cuando se combina para formaciones poli atómicos o moléculas.
NUMEROS DE
OXIDACIÓN
Los números de oxidación representan la
carga aparente que tiene un átomo cuando se combina con otros para formar una
molécula. No procede ahora ahondar en el porqué de esta definición, sino que
basta con aprenderse éstos para los átomos más comunes. En la siguiente tabla
están recogidos los estados de oxidación de los elementos del sistema
periódico. Si las miras detenidamente verás que en algunos casos se pueden
obtener reglas que te ayuden a memorizarlos
Los metales tienen números de oxidación positivos. Los no metales los
pueden tener tanto positivos como negativos.
Los metales de los grupos 1, 2 y 3 tienen estados de oxidación que
coinciden con el número del grupo.
Los metales de los grupos 4, 5, 6 y 7 tienen varios números de oxidación,
pero, como mínimo, presentan el número de oxidación del grupo.
Desde el grupo 14 al 17 podemos saber el número de oxidación negativo que
presentan sus elementos si restamos 18 al número de su grupo. Por ejemplo, para
el grupo 15 sería 15 - 18 = 3-.
CÁLCULO DEL NÚMERO DE OXIDACIÓN.
Para conocer el número de oxidación de un átomo, ya sea aislado o
formando parte de una molécula, podemos emplear las siguientes reglas:
1.El número de oxidación de los elementos en su estado natural es siempre
0, ya sean átomos aislados (Ni, K), moléculas diatómicas (Br2, I2) o
poliatómicas (P4, S8).
2. El número de oxidación del oxígeno es 2-, excepto en los peróxidos
(O2)2- que es 1- y 2+ en su combinación con el flúor.
3. El número de oxidación del hidrógeno es 1+ cuando está unido con
átomos no metálicos y 1- cuando lo está a átomos metálicos.
4. El número de oxidación del flúor es siempre 1-.
5. Cuando los elementos de los grupos 15, 16 y 17 forman combinaciones
binarias, usan el número de oxidación más bajo. Los elementos de los grupos 1,
2 y 3 siempre tienen estado de oxidación 1+, 2+ y 3+ respectivamente.
6. En un compuesto neutro, la suma de todos los números de oxidación debe
ser cero. En un ion poliatómico, la suma de los números de oxidación debe ser
igual a la carga neta del ion.
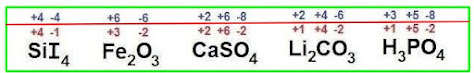
Ejemplos:
ACTIVIDAD
1. Diga los números de oxidación para los siguientes elementos sin combinar
Sodio, Cloro, Calcio, Oxígeno.
2. Cuál es el estado de oxidación del hidrógeno en los
siguientes compuestos:
a. HCl b.
H2O c.
HClO
3. Cual es el número de oxidación del oxígeno en los
siguientes compuestos:
a. CO b. Li2O
SEMANA NUMERO 30
FECHA: 9 de Septiembre al 13 de Septiembre
TEMA: Número de oxidación de los elementos químicos
OBJETIVO: Determina los estados de oxidación de los elementos en su estado libre o cuando se combina para formaciones poli atómicos o moléculas.
NUMERO DE OXIDACION
Observa el siguiente video:https://www.youtube.com/watch?v=jLElcElc-MU
Después de observar el video desarrolla la siguiente actividad:
ACTIVIDAD
1. Indique el estado
de oxidación para los siguientes elementos:
CH4
Fe2 O3
HClO4
MgO
HClO2
H2 S
Li2 O
SO3
ClO3
CuO
H2 CO3










No hay comentarios:
Publicar un comentario