PLAN DE APOYO SEGUNDO PERIODO CIENCIAS NATURALES
Objetivo: Proponer estrategias
para mejorar las falencias que se han presentado en el proceso formativo y de
aprendizaje en la asignatura de ciencias
naturales, realizando un proceso de seguimiento que permita evidenciar los
avances obtenidos.
Desempeños a fortalecer:
·
Analiza
la circulación como un mecanismo y función vital en los seres vivos
·
Reconoce
el flujo de energía en los ecosistemas, así como las consecuencias de la acción
humana sobre los recursos naturales.
·
Distingue
las transformaciones y cambios que presenta la materia
ACTIVIDADES PROPUESTAS
INSTRUCCIÓN: Lee
atentamente y responde las preguntas en hojas de block con letra
legible.
1. Diga en qué consiste
cada tipo de respiración que presentan
los animales en la siguiente imagen:
2. Relaciona la columna A con la columna B
3. Elabora un
dibujo del aparato circulatorio humano
con cada una de sus partes. Colorea a tu antojo.
4. Explica cinco enfermedades que afectan al sistema circulatorio humano.
¿Cómo podríamos
evitarlas?.
5. Teniendo en cuenta los diferentes tipos de ecosistema
elabora un dibujo donde estén los factores bióticos y abióticos de cada
ecosistema
6. Describe el ecosistema de tu ciudad
7. A qué le damos el nombre de transformaciones
químicas.
8. Cómo se puede transformar la materia y dar ejemplos
9. Qué tipos de transformaciones tiene la materia
10. Escoge la respuesta correcta ( si o no)
a. Un cambio físico es una transformación en la que
_____ se altera la naturaleza original
de la materia.
b. Un cambio químico es una transformación en la que ____ se altera la naturaleza
original de la materia
11. Clasifica las siguientes imágenes en cambio físico o cambio químico
SEMANA NUMERO 26
FECHA: 12 de Agosto al 16 de Agosto
TEMA: Taller preliminar sobre el medio ambiente
OBJETIVO: Presentación del docente y dar a conocer la temática que se va a
desarrollar durante el periodo.
ACTIVIDAD INTRODUCTORIA
1.
Defina las siguientes palabras: la
biología, medio ambiente, basuras,
2.
¿Qué pasa cuando se sacan las basuras de las casas?
3.
¿ Qué es reciclar? ¿ Qué materiales podemos reciclar?
4.
¿ Cómo podemos empezar a reducir las basuras?
5.
¿ Por qué el plástico se ha convertido en un problema?
6.
¿ Qué acciones podemos implementar para proteger el medio ambiente en la
institución y en nuestra comunidad?
7.
¿ Crees que es importante reciclar para cuidar el medioambiente?
8.
Elabora una frase en donde expreses amor y cuidado por el medio ambiente
9.
Elabora un dibujo sobre el cuidado del medio ambiente
SEMANA NUMERO 27
FECHA: 19 de Agosto al 23 de Agosto
TEMA: La tabla periódica de los elementos químicos
OBJETIVO: Reconoce la importancia
de la organización de los elementos químicos en un sistema periódico
LA TABLA PERIODICA
La tabla periódica o
sistema periódico es un esquema que muestra la estructura y disposición de los
elementos químicos, de acuerdo a una ley de periodicidad, la cual consiste en
que “las propiedades de los elementos son una función periódica de sus números
atómicos”. De esta manera, todos los elementos químicos se encuentran ordenados
en orden creciente de su número atómico. Además, la tabla periódica sirve para
mostrar las relaciones entre los distintos elementos y también puede ser usada
para predecir las propiedades de nuevos elementos descubiertos o de elementos
no sintetizados aún.
Desde los comienzos de
la era moderna de la Química, constituyó una gran preocupación de los investigadores
la ordenación de los elementos conocidos, con el objeto de relacionar sus
propiedades, entre los científicos destacados tenemos a Johann Wolfgang Döbereiner,
John Newlands, Dimitri I. Mendeléiev y Julius Meyer.
La tabla periódica
presenta en la parte superior derecha, en la mitad o en la parte inferior
izquierda una pista o clave, que nos indica como están organizadas las propiedades
o características de cada elemento químico, siendo más fácil buscarlas, así por
ejemplo:
La tabla periódica es
un sistema en el que los elementos químicos aparecen ordenados según su número
atómico (número de protones) en una disposición que reúne por columnas a
aquellos elementos con características similares.
Los elementos en la tabla
periódica se distribuyen en columnas denominadas GRUPOS y en filas denominadas PERIODOS.
Períodos: Son 7 Filas
horizontales, que nos dicen la cantidad de niveles de energía que presenta el
elemento químico. Se nombran con números arábigos del 1 al 7.
ACTIVIDAD
1. ¿Qué es un grupo y
un periodo en la tabla periódica?
2. ¿En qué grupo y
periodo se encuentran los siguientes elementos: Hidrogeno, calcio, flúor, azufre,
hierro.
3. Completa la
siguiente información de los elementos químicos
|
Elemento |
Símbolo |
Numero
atómico |
Masa
Atómica |
Grupo |
Periodo |
Electrones
de Valencia |
Niveles
de Energía |
|
Sodio |
|
|
|
|
|
|
|
|
Oxígeno |
|
|
|
|
|
|
|
|
Bromo |
|
|
|
|
|
|
|
4. Investiga
3 elementos químicos y su importancia en la vida cotidiana. Diseña un poster
donde incluyas la información y dibujos que representen los usos de dichos
elementos químicos.
5. Consulta cinco características
de los elementos metales y nometales.
SEMANA NUMERO 28
FECHA: 26 de Agosto al 30 de Agosto
TEMA: Estructura
del Átomo
OBJETIVO: Explicar
la diferencia entre protones, neutrones, y electrones
LECTURA COMPRENSIVA SOBRE EL
ATOMO
Desde la antigüedad los filósofos se preguntaban de qué estaban formadas
las cosas que los rodeaban. Primero pensaron que la materia era continua, es
decir, que se podía dividir indefinidamente. Sin embargo, en el siglo V a. C.,
Leucipo (450-370 a. C.) y su discípulo Demócrito (460-370 a. C.) postularon la
idea de que la materia era discontinua, es decir, que se podía dividir solo
hasta cierto punto, ya que estaba formada por diminutas partículas a las que
llamó átomos (a=sin; tomos=división).
Como la idea de Demócrito solo fue basada en su intuición (no tenía datos
experimentales) no se tomó en cuenta por mucho tiempo. Solo unos 2.000 años
después, John Dalton (1766-1844) retomó la idea planteada por Demócrito.
Estructura del Átomo
Un conjunto de
átomos del mismo tipo forman un elemento químico determinado.
Para poder
representar y distinguir un elemento químico se utiliza un símbolo químico y
dos números, conocidos como: número atómico y número másico.
El número atómico
(Z) indica el número de protones que contiene el núcleo atómico. Para un átomo neutro,
el número de protones es idéntico al número de electrones.
El número másico
(A) indica el número de protones más neutrones que tiene el átomo en su núcleo.
ACTIVIDAD
1. Observa la imagen
y completa la siguiente tabla
Completa la siguiente información para cada uno de los siguientes elementos
Nombre:
Símbolo:
Numero atómico:
Número másico:
Número de protones:
Número de electrones
Número de neutrones:
SEMANA NUMERO 29
FECHA: 2 de Septiembre al 6 de Septiembre
TEMA: Tabla periódica y su relación con los elementos químicos
OBJETIVO: Reconoce la tabla periódica, su uso e interpretación para obtener datos comparativos y determinar las propiedades físicas y químicas de los elementos
TABLA PERIODICA Y SU RELACION CON LOS ELEMENTOS QUIMICOS
Un elemento químico es un tipo de
materia constituida por átomos de la misma clase. En su forma más simple posee
un número determinado de protones en su núcleo, haciéndolo pertenecer a una
categoría única clasificada con el número atómico, aun cuando este pueda
desplegar distintas masas atómicas. Es un átomo con características físicas
únicas, aquella sustancia que no puede ser descompuesta mediante una reacción
química, en otras más simples. Un elemento químico es una sustancia pura
formada por átomos que tienen el mismo número atómico, es decir, el mismo
número de protones o de electrones. Cada elemento se distingue de los demás por
sus propiedades características. Se denomina número atómico al número de protones
que tiene el núcleo de un átomo. Este número es igual al número de electrones
que el átomo neutro posee alrededor del núcleo.
Algunos elementos se han
encontrado en la naturaleza y otros obtenidos de manera artificial, formando
parte de sustancias simples o de compuestos químicos. Otros han sido creados
artificialmente en los aceleradores de partículas o en reactores atómicos.
Estos últimos suelen ser inestables y sólo existen durante milésimas de segundo.
A lo largo de la historia del universo se han ido generando la variedad de
elementos químicos a partir de núcleo síntesis en varios procesos,
fundamentalmente debidos a estrellas. Los elementos químicos se representan a
través de los llamados SIMBOLOS QUIMICOS los cuales proceden de sus nombres en
griego, latín, inglés, árabe o llevan el nombre de su descubridor o ciudad en
que se descubrieron, como por ejemplo:
• Litio (Li): del griego lithos, roca de color rojo muy
intenso a la flama.
• Nitrógeno (N): en griego nitrum, ‘engendrador de nitratos’
• Sodio (Na): Del latín sodanum (sosa). El símbolo Na viene
del latín nátrium (nitrato de sodio) color amarillo a la flama.
• Fósforo (P): del griego phosphoros, ‘portador de luz’ (el
fósforo emite luz en la oscuridad porque arde al combinarse lentamente con el
oxígeno del aire).
• Zinc (Zn): del alemán zink, que significa origen oscuro.
• Galio (Ga): de Gallia (nombre romano de Francia).
• Germanio (Ge): de Germania (nombre romano de Alemania).
• Mendelevio (Md): en honor al químico ruso Dimitri
Ivánovich Mendeléiev, precursor de la actual tabla periódica.
• Nobelio (No): en honor de Alfred Nobel.
A partir del número atómico 113, se nombra a los elementos
con la nomenclatura temporal de la IUPAC, en la que a cada elemento le
corresponde como nombre su número en latín.
La relación que tienen los elementos con la tabla periódica es que la tabla periódica contiene los elementos químicos en una forma de ordenada de acuerdo a su peso atómico, estableciendo más de 118 elementos conocidos. Algunos se han encontrado en la naturaleza, formando parte de sustancias simples o compuestos químicos. Otros han sido creados artificialmente en los aceleradores de partículas o en reactores atómicos. Estos últimos son inestables y sólo existen durante milésimas de segundo.
A principios del Siglo XIX, los científicos vieron la necesidad de clasificar los elementos de alguna manera que permitiera un estudio más sistematizado de ellos. Para tal efecto, se tomaron como base las similitudes químicas y físicas de los elementos que se conocían por entonces.
Una primera organización de los
elementos químicos fue en dos grandes grupos: metales y no metales, elaborada
por Lavoisier, a la que le siguió una clasificación de Dumas en Familias
(Halógenos y Anfígenos). Luego en 1817 Doeberenier, observó que para ciertos
grupos de tres elementos (Triadas), existían similitudes en sus propiedades; en
1864 el inglés Newlands, ordenó los elementos en orden creciente de sus masas atómicas
en ocho grupos (Octavas). 1869, Mendeléiev y Meyer promulgaron la Ley Periódica
para organizar los elementos, la cual se enuncia así: ¨ Si se ordenan los elementos
según sus masas atómicas crecientes se puede observar que periódicamente se
repiten algunos conjuntos de propiedades ¨.
La Tabla Periódica Moderna se basa en los trabajos de Mendeléiev, sustituyendo el ordenamiento periódico en función de las masas atómicas por otro basado en los Números Atómicos y que constituye la Ley Periódica Moderna: ¨ las propiedades de los elementos son función periódica de sus números atómicos¨.
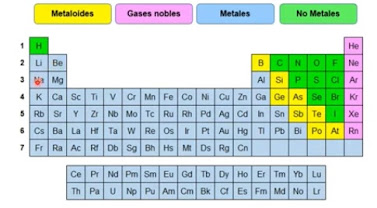
La Tabla Periódica permite clasificar los elementos en metales, no metales y gases nobles. Una línea diagonal quebrada ubica al lado izquierdo los metales y al lado derecho los no metales. Los elementos que se encuentran cerca de la diagonal presentan propiedades de metales y no metales por los que reciben el nombre de metaloides o anfotéricos.
ACTIVIDAD
1. Elabore un cuadro comparativo de las propiedades de los elementos metálicos y no metálicos.
2.
Consulte la importancia que tienen algunos de los Elementos Químicos a nivel
Biológico e Industrial. A que se denominan Bioelementos
3.
En un croquis de la Tabla Periódica ubica los símbolos químicos de los elementos
dados a continuación, según sean metales, no metales, gases nobles y metaloides al cual pertenecen: Estroncio, Oxígeno, Aluminio, Carbono, Sodio. Magnesio,
Bromo, Helio, Xenón, Bario, Hierro, Fósforo, Azufre, Nitrógeno, Cloro, Potasio,
Calcio, Silicio, Cobre, Bario, Litio, Yodo, Boro, Selenio, Flúor, Zinc, Cromo,
Mercurio, Estaño, Arsénico.
SEMANA NUMERO 30
FECHA: 9 de Septiembre al 13 de Septiembre
TEMA: Tabla periódica y su clasificación
OBJETIVO: : Identifica la estructura y el comportamiento de las Propiedades Periódicas de los elementos químicos y establece su clasificación.
LA
TABLA PERIODICA Y SU CLASIFICACION
La Tabla Periódica Moderna se basa en
los trabajos de Mendeléiev, sustituyendo el ordenamiento periódico en función
de las masas atómicas por otro basado en los Números Atómicos y que constituye
la Ley Periódica Moderna: ¨ las propiedades de los elementos son función
periódica de sus números atómicos¨.
Sobre la base de su configuración
electrónica, los elementos químicos se pueden clasificar en cuatro grupos:
a) Gases inertes: presentan una órbita
electrónica externa completa con ocho electrones, con excepción del He que
tiene dos. Ocupan el grupo 18 de la tabla periódica.
b)
Elementos representativos: aquellos que tienen su órbita externa incompleta.
Comprende a los elementos que ocupan los grupos 1, 2, 13, 14, 15,16 y 17 de la
tabla periódica.
c)
Elementos de transición: se caracterizan por presentar sus dos últimas
órbitas incompletas. Corresponden a esta clase los elementos de los grupos 3,
4, 5, 6, 7, 8, 9, 10,11 y 12.
d)
Elementos de transición interna: son los que presentan sus tres
últimas orbitas incompletas
La tabla periódica se puede también dividir en bloques de elementos según el orbital que estén ocupando los electrones más externos. Los bloques o regiones se denominan según la letra que hace referencia al orbital más externo: s, p, d y f
Los elementos a su vez se clasifican
en dos grandes subgrupos:
Representativos
(a): pertenecen a las regiones s y p
Transición
(b): pertenecen a las regiones d y f
Los grupos de la tabla periódica se identifica a través de familias, se expresan
en Números Romanos (I, II, II, IV, etc) y cada uno de los periodos de la tabla
periódica de identifican con números arábigos
(1.2.3.4. etc) respectivamente.
Según su carácter metálico en:
Metales:
perteneces a las regiones s y d
No metales: pertenecen a la región p
ACTIVIDAD
1. En un croquis de la Tabla
Periódica ubica los símbolos químicos de los elementos dados a continuación,
según sean el bloque elementos representativos, elementos de transición y gases
inertes al cual pertenecen: Magnesio, Estroncio, Zinc, Flúor, Fosforo, Potasio,
Bario, Cromo, Plata, Manganeso, Sodio, Cloro, Hierro, Cobre, Renio.
2. Consulta cómo se ha desarrollado la
Industria Minera en Colombia y en el Departamento. Que impacto ambiental se ha
presentado por la misma. Exponga su punto de vista
3. Consulta que Elementos Químicos se
han descubierto recientemente y como se identifican.














No hay comentarios:
Publicar un comentario